医疗器械软件质量管理体系文件–01软件生存周期过程控制程序 在介绍写程序文件之前,我们先达成一个共识:任何质量管理体系文件核心思想是:为公司创造价值第一、符合相关法律法规第二; 1、目的 越简洁越好,例如:“规范医疗器械软件生存周期过程控制。” 2、适用范围 越简洁越好,例如“适用于xx公司所有医疗器械软件软件设计和开发控制,覆盖从初始概念到最终停用和处置所有阶段的生存周期控制。” 3、职责 职责描述注意点: 越贴近公司组织架构越好,与岗位职说明书保持一致、最好不要以项目维度重新定义项目角色,以免造成沟通成本增加和职责不清现象。 越贴近业务流程越好,与业务流程所需职责保持一致,最低要cover住业务流程所需职责,以防止体系运行时出现无人负责情况。 岗位职能齐全,就算只有2人开发的医疗器械软件,也要开发和质量(测试)两个独立岗位。 例如这样设置: 3.1 研发负责人 产品经理、技术负责人职责都合并到这个角色上; 3.2 评审团队 略 3.3 质量 项目经理和质量可合并到这一个角色上; 3.4 项目组 各职能部门职责用统一话术描述,但是要根据组织架构介绍项目组,不要有遗漏,例如: 项目组成员包括:研发、质量、采购、注册、生产等,具体职责如下: 制定职能领域内工作计划、并与整体项目计划保持一致; 完成产品设计和开发计划中职能领域的活动和交付; 与职能部门负责人沟通相关问题。 4、定义 描述此文件中用到的所有术语,特别是法规中有定义的术语,一定要与法规保持一致,目的防止出现鸡同鸭讲现象。例如: 4.1 生存周期 生存周期是指从一个医疗器械最初概念的形成到最终的退出市场和处置的整个生命中的全部阶段(包括:设计开发阶段到监控&维护阶段)。 4.2 设计历史文档(DHF) 设计历史文档是指对于一个设计完成的医疗器械产品,描述该设计历史记录的汇编,称为设计历史文档。 4.3 验证(Verification) 验证是指通过检查和提供客观证据来证实设计输出实现了设计要求。 4.4 确认(Validation) 确认指通过检查和提供客观证据来证实一个过程或设计,能始终如一的满足一定预期用途的特殊要求。 5、流程图 纯软件开发采用敏捷模式的比较多,但是从最最根本上来讲,我们还是用软件工程(在软件(包括程序和文档)设计,实现,测试,运行,维护的各过程中,建立在科学基础上的一套实用方法。)来完成每次迭代的功能。所以敏捷模式也是可以的。因为要保证医疗器械软件有效和安全,跟非医疗器械软件比,在软件生存周期控制上主要有如下几点不同: a) 风险管理要求比较高,需要实实在在的做风险管理,而且全生存周期管理。 b) 记录要求比较高,特别是设计文档、验证记录、可追溯性、评审记录等,这相当于是对风险管理的另外一种手段。—-设计大家都理解,但是验证记录、追溯性、评审记录为啥要有呀?没有的话,可能就会漏做,举个曾经在一家公司亲身经历过的未按照规则评审返工的例子,我们对单测试评审的内容主要2块:1测试报告,2测试日志,有一次开发改了代码,单测试脚本改错了,测试报告上显示所有用例测试通过,但是日志显示有问题,大家当时就没按照单测试评审的要求进行评审,这个问题一直到系统测试结束,所有测试记录归档前最后复审时才发现。你设身处地的想象一下,这是团队当时是什么感受。 c) 验证过程特有的注册检验,这验证过程可以理解为监管机构委托第三方对企业开发出来的医疗器械软件进行验收,验收合格可以执行下一步,不合格打回。 d) 验证过程特有的临床试验,其实这个验证过程可以简单理解为互联网的灰度发布验证过程,即少量真实用户使用,在一定程度上可代表用户确认。 e) 运行环境发布特有要求,是要根据医疗器械软件注册审查指导原则相关要求,做相应的变更注册或备案。 流程图样例:根据公司业务情况,纵向横向或其他表达方式都可以,但是一定要包含类似图1“监控和维护”的相关阶段,因为有了这个阶段就符合法规要求的全生存周期要求了。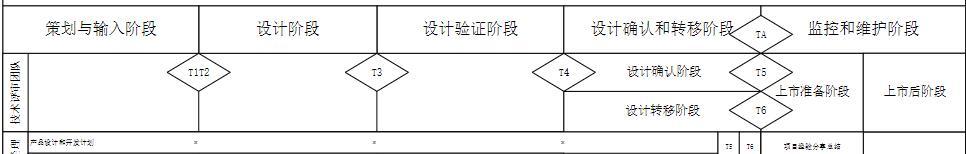

2024最新激活全家桶教程,稳定运行到2099年,请移步至置顶文章:https://sigusoft.com/99576.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌侵权/违法违规的内容, 请联系我们举报,一经查实,本站将立刻删除。 文章由激活谷谷主-小谷整理,转载请注明出处:https://sigusoft.com/76564.html