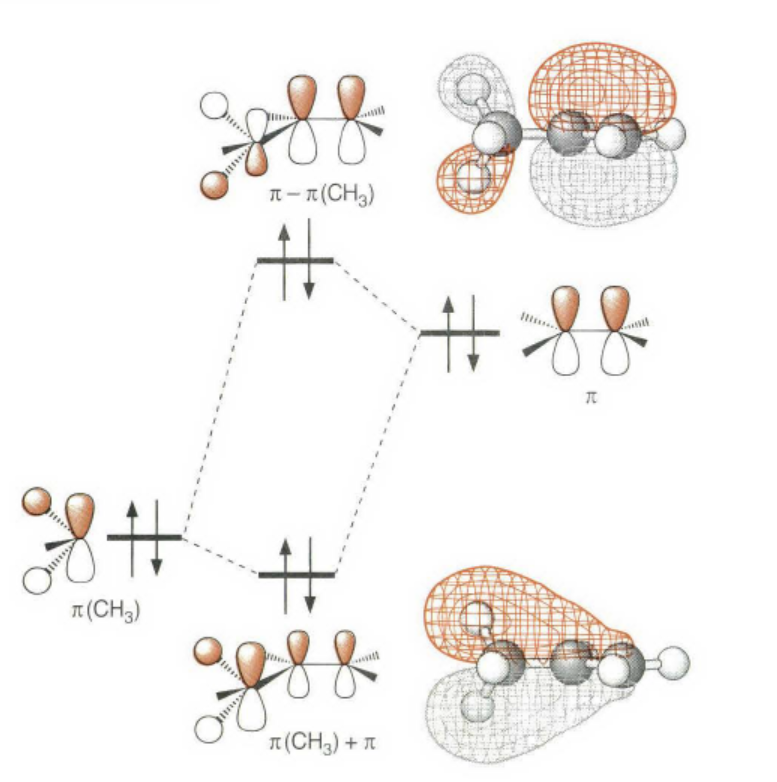
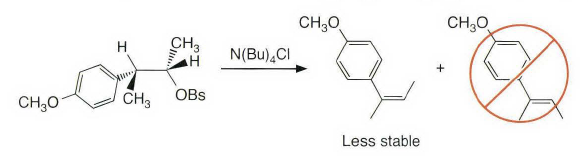
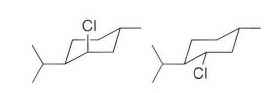
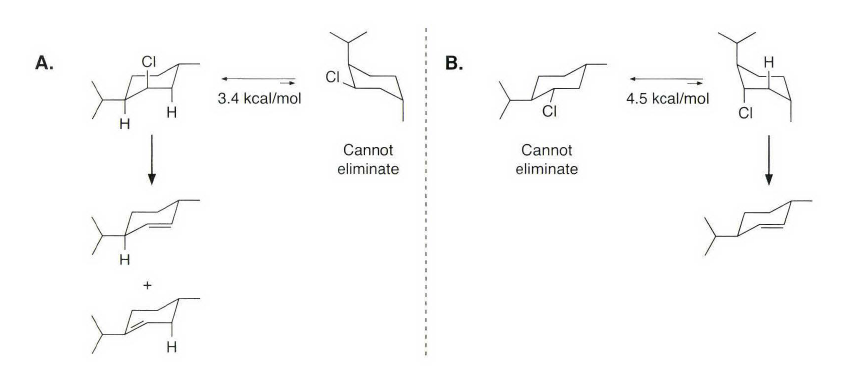
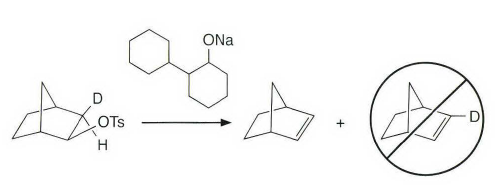
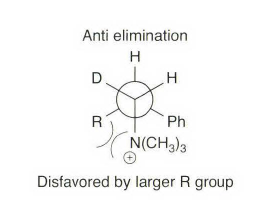
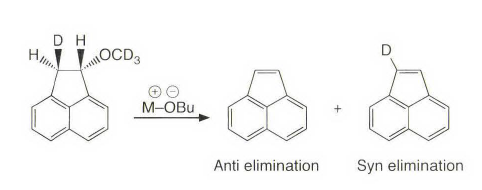
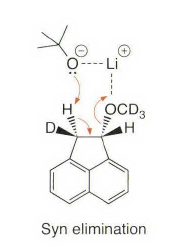
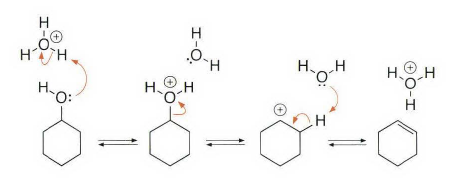
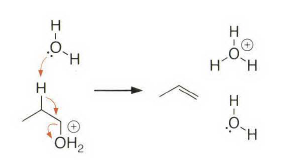
《现代物理有机化学》笔记 第十章(10)消除反应3 之前说了这章是用基础化学里的例子讲解前面说的热力学动力学方法怎么用,结果还是有人评价“邢大本里都有”,可能是时代不同了吧,邢大本现在有More O’Ferrall-Jencks图和动力学分析了?那还是尽快结束这一章吧,看来想知道机理背后实验证据的人不多,还是喜欢推机理的人多。记得之前有朋友说看不下去福山透主笔的《演習で学ぶ 有機反応機構》也是因为前“邢大本上就有,没意思”,所以又听到这话很感慨。人们总是对新的知识充满兴趣,又总觉得自己学完了大部分知识。 本节没有什么重点,基础有机化学里基本讲过。本书中的例子和March中的差不多,说明这块也没太多花样了,只要知道最常见的是扎伊采夫规则+反式消除产物就好了。要再深挖一些的话应该了解E2反应类似SN2,具有高度的反式消除选择性,而E1和E1cB选择性就没那么明显了。本章还可以回顾很多动力学的内容。 10.13.7 消除反应的区域化学 基本就是形成“多取代的烯烃产物”的扎伊采夫Saytzaff 消除规则,和形成“取代少的烯烃产物”霍夫曼Hofmann消除规则。 俄罗斯人扎伊采夫有个同门师兄弟叫马尔可夫尼科夫Markovnikov,两人为了区域选择性规则争论过很多年,扎伊采夫最有名的研究是有机锌化学(格氏试剂是后来受有机锌启发产生的),大浪淘沙,现在最有名的可能是扎伊采夫的徒弟Reformatsky瑞弗马斯基。[1] 一般底物消除时都遵守Saytzaff 规则。E1反应由于碳正离子中间体本身具有平面构型,一般遵守形成热力学稳定产物的Saytzaff 规则。但注意出现紧密离子对时可能导致动力学产物为主的情况。 在E2反应中倾向形成Saytzeff 消除产物的合理解释类似于上面E1的原因。当碱夺去质子和离去基团离去时,过渡态具有的双键特征的程度足够大,多取代双键形成这样过渡态的能垒较低。随着碱性增强,碱越活泼,脱质子的选择性越差。 在E1cB反应中,区域化学完全由要脱除质子的相对酸性决定。形成的双键定位于带有酸性最强质子的碳。 如果存在严重的位阻因素使得在取代多的碳上的氢难以接近, 符合Hofmann规则的产物将比较多。注意因为国内教材中很多在Hofmann消除时讲Hofmann规则,以至于有人以为只有Hofmann消除反应才会得到Hofmann规则产物,这当然不对。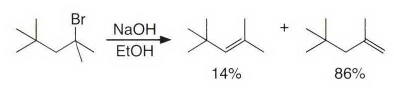
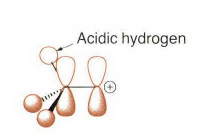
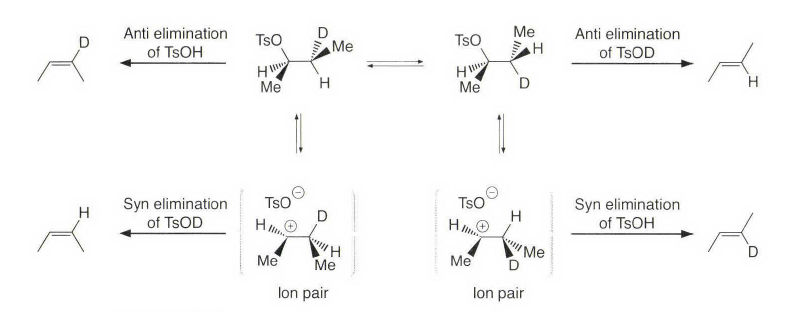
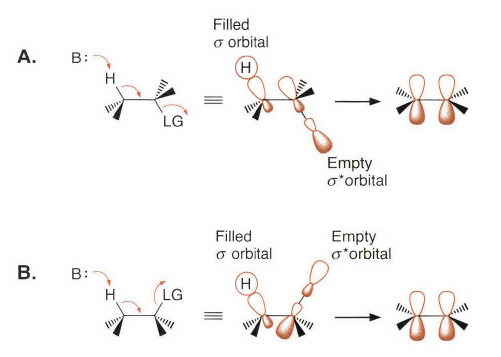
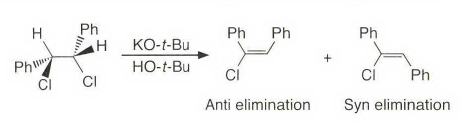
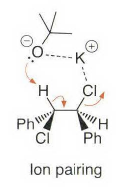
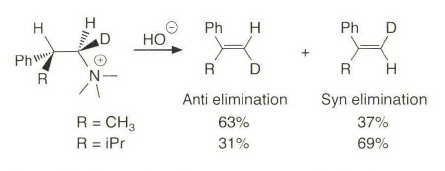
 处理大位阻的情况,有季铵盐和硫鎓离子的离去基团发生消除反应时优先进行符合Hofmann规则的消除反应。上面这种季铵盐消除就被称为Hofmann消除。
处理大位阻的情况,有季铵盐和硫鎓离子的离去基团发生消除反应时优先进行符合Hofmann规则的消除反应。上面这种季铵盐消除就被称为Hofmann消除。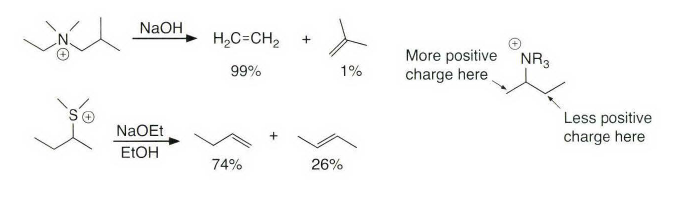



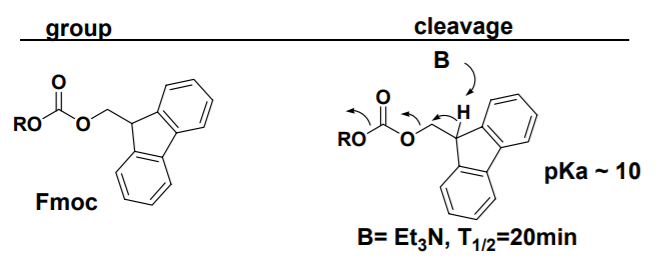
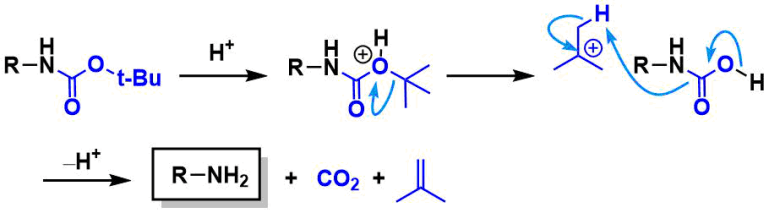
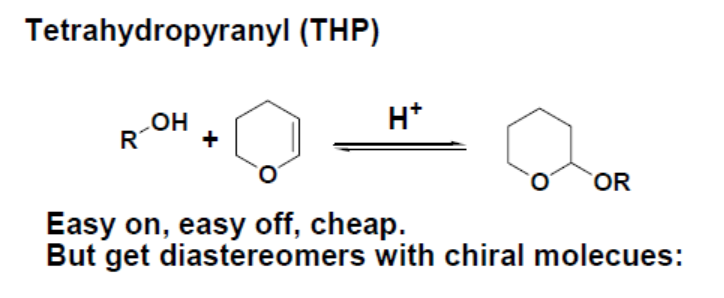
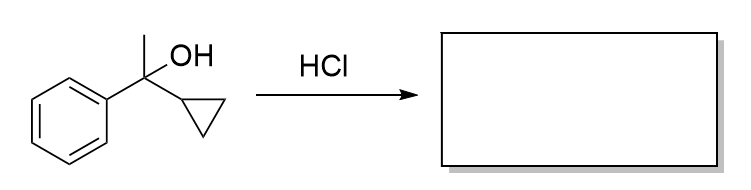
2024最新激活全家桶教程,稳定运行到2099年,请移步至置顶文章:https://sigusoft.com/99576.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌侵权/违法违规的内容, 请联系我们举报,一经查实,本站将立刻删除。 文章由激活谷谷主-小谷整理,转载请注明出处:https://sigusoft.com/45371.html