大家好,最近实验室的BCA仪器坏了,偶然发现nanodrop也可以测蛋白浓度,省不少时间!本方法原理是:紫外吸收
友情提示:由于表格的存在,用电脑看本推文,效果更好
|
紫外吸收法 |
较为灵敏50~100mg |
快速 5~10分钟 |
蛋白质中的酪氨酸和色氨酸残基在280nm处的光吸收 |
各种嘌吟和嘧啶;各种核苷酸 |
用于层析柱流出液的检测;核酸的吸收可以校正 |
-
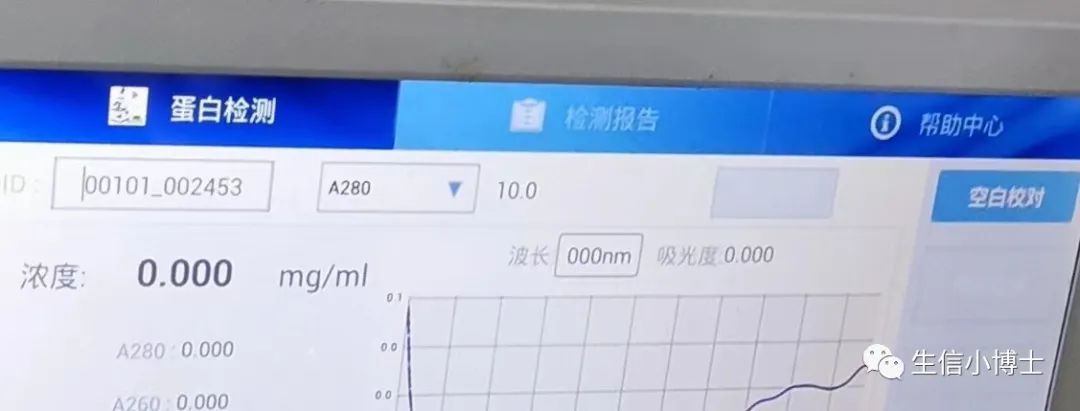
选择A280波长,测蛋白浓度
-
准备工作区域,确保工作台面干净,并清洁使用的移液器和试管。
-
使用纯水或缓冲液,而不是待测的蛋白质样品,进行blank校准。将一小量纯水或缓冲液(与待测样品相同的体积)放置到NanoDrop测量盖片上。
-
使用无菌纸巾轻轻擦拭测量盖片以去除表面的杂质。
-
将测量盖片放置到NanoDrop仪器的测量槽中,并关闭仪器盖子。
-
在仪器软件中选择蛋白质浓度的测量模式。
-
测量按钮开始进行blank校准,并等待一段时间直到校准完成。
-
校准完成后,移除blank样品并清洁测量盖片。
-
取一小量待测的蛋白质样品(通常约为1-2微升)并将其转移到新的NanoDrop测量盖片上。
-
使用无菌纸巾轻轻擦拭测量盖片以去除表面的杂质。
-
将测量盖片放置到NanoDrop仪器的测量槽中,并关闭仪器盖子。
-
测量按钮开始测量,并等待一段时间直到测量完成。
-
读取测量结果,包括吸光度值和蛋白质浓度。通常,吸光度值在280纳米波长处进行测量,该波长对应着蛋白质的最大吸收峰。
如果想更准确一些,可以加上自己的标品,测一遍标品的浓度,制作标曲。
附:
五种蛋白质测定方法比较如下:
| 方法 | 灵敏度 | 时间 | 原理 | 干扰物质 | 说明 |
| 凯氏定氮法(Kjedahl法) | 灵敏度低,适用于0.2~ 1.0mg氮,误差为 ±2% | 费时 8~10小时 | 将蛋白氮转化为氨,用酸吸收后滴定 | 非蛋白氮(可用三氯乙酸沉淀蛋白质而分离) | 用于标准蛋白质含量的准确测定;干扰少;费时太长 |
| 双缩脲法(Biuret法) | 灵敏度低1~20mg | 中速 20~30分钟 | 多肽键+碱性Cu2+®紫色络合物 | 硫酸铵;Tris缓冲液;某些氨基酸 | 用于快速测定,但不太灵敏;不同蛋白质显色相似;BCA鳌合Cu+作为显色剂,产生蓝紫色并在562nm有吸收峰 |
| 紫外吸收法 | 较为灵敏50~100mg | 快速 5~10分钟 | 蛋白质中的酪氨酸和色氨酸残基在280nm处的光吸收 | 各种嘌吟和嘧啶;各种核苷酸 | 用于层析柱流出液的检测;核酸的吸收可以校正 |
| Folin-酚试剂法(Lowry法) | 灵敏度高~5mg | 慢速 40~60分钟 | 双缩脲反应;磷钼酸-磷钨酸试剂被Tyr和Phe还原 | 硫酸铵;Tris缓冲液;甘氨酸;各种硫醇 | 耗费时间长;操作要严格计时;颜色深浅随不同蛋白质变化 |
| 考马斯亮蓝法(Bradford法) | 灵敏度最高1~5mg | 快速5~15分钟 | 考马斯亮蓝染料与蛋白质结合时,其lmax由465nm变为595nm | 强碱性缓冲液;TritonX-100;SDS | 最好的方法;干扰物质少;颜色稳定;颜色深浅随不同蛋白质变化 |
2024最新激活全家桶教程,稳定运行到2099年,请移步至置顶文章:https://sigusoft.com/99576.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌侵权/违法违规的内容, 请联系我们举报,一经查实,本站将立刻删除。 文章由激活谷谷主-小谷整理,转载请注明出处:https://sigusoft.com/163442.html